Publikacja nt. podwyższonej ekspresji czynnika dopełniacza I w komórkach raka płuc
5.03.2024
Naukowcy Gdańskiego Uniwersytetu Medycznego są współautorami publikacji zatytuowanej Elevated expression of complement factor I in lung cancer cells associates with shorter survival – Potentially via non-canonical mechanism opublikowanej w czasopiśmie Translational Research (IF=7,8). Pracę zrealizowano we współpracy międzynarodowej ze specjalistami z Hiszpanii, Holandii, Szwecji oraz Norwegii.
Pierwszą autorką pracy jest dr Anna Felberg z Zakładu Biologii Komórki i Immunologii GUMed, a w jej powstanie zaangażowani byli inni badacze z tej samej jednostki: dr Grzegorz Stasiłojć, mgr Daria Kowalska, mgr Alicja Kuźniewska oraz prof. Marcin Okrój pełniący rolę autora korespondującego.
Ponadto swój wkład do badań wniósł zespół z Zakładu Enzymologii i Onkologii Molekularnej GUMed: mgr Zuzanna Polakiewicz, dr Kamila Kitowska i prof. Rafał Sądej, a także dr Kamil Myszczyński z Centrum Analiz Biostatystycznych i Bioinformatycznych oraz dr Michał Bieńkowski z Katedry i Zakładu Patomorfologii GUMed.
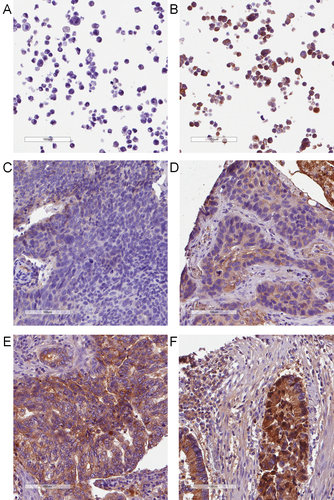
Fig. 1. Immunohistochemical staining of FI in lung cancer cell lines and tissue microarrays from lung cancer patients. Formalin-fixed paraffin-embedded (FFPE) pellets of lung cancer cell lines not expressing (A) and expressing (B) FI were used to setting up the staining parameters. The same conditions were applied to the staining of tissue microarrays generated from FFPE lung cancer tissues of patients. Pictures C-F show examples of lung cancer tissues scored as negative (-), positive (), strongly positive (+), and extremely positive (+), a measure that was further implemented in the H-score assessment.
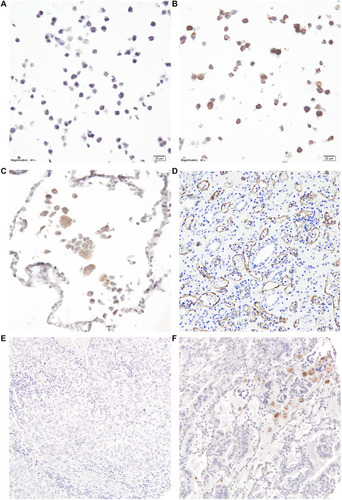 Fig. 3. Immunohistochemical staining of C4d. The staining was first validated in FFPE pellets of Raji cells sensitized with anti-CD20 antibody rituximab in FI-depleted serum (A) and the same serum reconstituted with FI (B). The same conditions were applied for the staining of normal lung tissue©, kidney transplant tissue showing antibody-mediated rejection (D) and lung cancer tissues from patients (E-F).
Fig. 3. Immunohistochemical staining of C4d. The staining was first validated in FFPE pellets of Raji cells sensitized with anti-CD20 antibody rituximab in FI-depleted serum (A) and the same serum reconstituted with FI (B). The same conditions were applied for the staining of normal lung tissue©, kidney transplant tissue showing antibody-mediated rejection (D) and lung cancer tissues from patients (E-F).
Autorzy zauważyli obniżenie czasu przeżycia wolnego od progresji u pacjentów, którzy w swoich komórkach nowotworowych mieli podwyższoną ekspresję jednego z inhibitorów układu dopełniacza – czynnika I (FI). W świetle dotychczasowej wiedzy obserwacja zdawała się logiczną konsekwencją ekspresji inhibitora, który zapewnia komórkom nowotworowym większy stopień oporności na atak układu immunologicznego pacjenta, w związku z czym guz rośnie i przerzutuje szybciej. Dla potwierdzenia takiej hipotezy w materiale od pacjentów wykonano kolejne barwienie immunohistochemiczne obrazujące produkt degradacji aktywnego składnika dopełniacza C4b – fragment C4d, który powstaje dzięki aktywności FI. Ku zaskoczeniu, nie zaobserwowano żadnej korelacji między obecnością substratu (C4b), produktu (C4d) oraz enzymu przeprowadzającego reakcję (FI), co sugerowało nieznany dotychczas powód obserwowanych gorszych rokowań dla pacjentów. Do wyjaśnienia zjawiska badacze użyli techniki edycji genomu CRISPR/Cas9 i stworzyli klony ludzkich komórek raka płuc pozbawione swojej naturalnej ekspresji FI.
RNA wyizolowane z komórek poddano sekwencjonowaniu, a jego wyniki analizom bioinformatycznym. Dodatkowo komórki produkujące FI i pozbawione FI zostały poddane analizie ścieżek sygnalizacyjnych po cyklu czasowego wyeliminowania z pożywki hodowlanej surowicy i ponownej stymulacji komórek za jej pomocą. Sprawdzono także, jak obydwa typy komórek radzą sobie z tworzeniem kolonii 3D w żelu imitującym substancję zewnątrzkomórkową, w oderwaniu od jakichkolwiek komórek układu immunologicznego czy dedykowanych aktywatorów układu dopełniacza. Wyniki wykazały, że sama obecność lub nieobecność FI w komórce wpływa znacząco na ekspresję kilkudziesięciu genów, w tym genów receptorów dla czynników wzrostu, genów kontrolujących metabolizm czy proces zaprogramowanej śmierci, a obecność FI daje komórkom przewagę widoczną m.in. w tym, że szybciej tworzą duże kolonie i w mniejszym stopniu są podatne na związki cytotoksyczne jak np. etopozyd.
– Do tej pory układ dopełniacza uważany był za jeden z mechanizmów działających w ramach odporności nieswoistej. Z najnowszych badań wyłania się jednak zupełnie inna, prawdopodobnie pierwotna funkcja tego układu – mianowicie zanim na przestrzeni ewolucji stał się zewnątrzkomórkowym strażnikiem organizmu, pełnił rolę w transdukcji sygnału wewnątrz komórki. Jest więc bardzo prawdopodobne, że odkryto kolejny z archaicznych aspektów funkcji układu dopełniacza, który w tym przypadku ma bezpośredni wpływ na zachowanie komórek raka płuc – tłumaczył prof. Marcin Okrój. – Potencjał translacyjny tego odkrycia polega na tym, iż precyzyjna identyfikacja elementu lub wycinka kaskady dopełniacza odpowiadającego za podwyższenie potencjału rozwoju komórek nowotworowych dającego im lepsze warunki wzrostu (i co za tym idzie – gorsze rokowania dla pacjenta), byłaby krokiem w kierunku skutecznej terapii wspomagającej. Na rynku istnieje cały szereg leków modulujących aktywność kaskady dopełniacza, dla których znany jest profil bezpieczeństwa, tolerowalna dawka, farmakokinetyka itp., zatem ewentualnie zadysponowanie ich w nowych wskazaniach stanowiłoby znacznie mniejsze wyzwanie i koszt niż opracowanie nowego leku od podstaw.