Publikacja w „Nature” o nowych mechanizmach regulujących cykl komórkowy
5.09.2024

Doktor Bartłomiej Tomasik z Katedry i Kliniki Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego jest współautorem artykułu pt. CDK5–cyclin B1 regulates mitotic fidelity opublikowanego w czasopiśmie Nature. Wyniki tego badania, przeprowadzonego w wiodących ośrodkach badawczych w Stanach Zjednoczonych (Dana-Farber Cancer Institute, Harvard Medical School, Fred Hutchinson Cancer Center), rzucają nowe światło na procesy regulujące cykl komórkowy.
– W latach 2020-2021 w ramach stażu podoktorskiego realizowanego m.in. dzięki wsparciu Narodowej Agencji Wymiany Akademickiej i programowi im. prof. Walczaka pracowałem w Division of Radiation and Genome Stability, Department of Radiation Oncology, Dana-Farber Cancer Institute, Harvard Medical School. Od tamtej pory ściśle współpracuję z dwoma zespołami, którymi kierują prof. Dipanjan Chowdhury oraz prof. Alexander Spektor – mówił dr Bartłomiej Tomasik. – Powyższa publikacja stanowi owoc współpracy tych dwóch zespołów. Mój udział w projekcie dotyczył przede wszystkim eksperymentów związanych z oceną zmian fosforylacji białek biorących udział w mitozie w odpowiedzi na zahamowanie CDK5.
Kluczowymi regulatorami cyklu komórkowego są kinazy zależne od cyklin (CDKs) oraz ich aktywatory, cykliny. Przez lata uważano, że CDK5 jest „nietypowa” ze względu na jej aktywację przez białka nienależące do cyklin (p35 oraz p39) oraz fizjologiczne występowanie jedynie w komórkach nerwowych, które nie ulegają podziałom. Z tego powodu CDK5 uważana była za CDK niezwiązaną z cyklem komórkowym. Jednocześnie istniały doniesienia wskazujące, że CDK5 występuje w nadmiarze w wielu nowotworach i może napędzać proliferację komórek nowotworowych, ale sposób, w jaki CDK5 miałaby regulować proliferację tych komórek, pozostawał niejasny.
W pracy CDK5–cyclin B1 regulates mitotic fidelity wykazano, że CDK5 odgrywa kluczową rolę w mitozie. Aby to osiągnąć, badacze zastąpili natywną CDK5 wariantem, który specyficznie wiąże się z substancjami hamującymi lub degradującymi CDK5 przed wejściem komórek w mitozę. Naukowcy udowodnili, że komórki pozbawione CDK5 wykazują zaburzenia wrzeciona mitotycznego, czyli struktury, na której powielone chromosomy poruszają się podczas podziału komórek. W efekcie chromosomy nie mogą być prawidłowo rozprowadzane do komórek potomnych, co skutkuje genetycznie niestabilnymi komórkami potomnymi i prowadzi do tworzenia nieprawidłowych struktur jądrowych, takich jak np. mikrojąderka. Co zaskakujące, okazało się, że CDK5 działa poprzez współpracę z cykliną B1, tą samą cykliną mitotyczną, która współdziała z CDK1, kluczowym regulatorem mitozy, we wszystkich etapach podziału komórkowego. Tym samym badacze wykazali, że CDK5 należy do kanonicznych kinaz regulujących cykl komórkowy i jest niezbędna do utrzymania stabilności genomu.
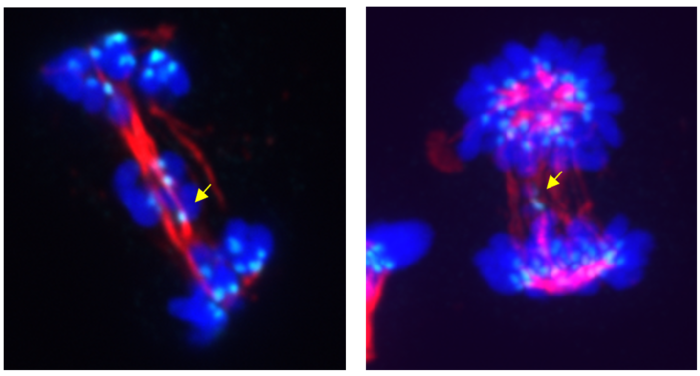
Nieprawidłowy podział komórkowy na skutek hamowania (lewy panel) lub degradacji (prawy panel) CDK5 – żółtymi strzałkami zaznaczono chromosomy, które podczas anafazy nie przemieściły się do komórek potomnych (ang. lagging chromosomes). Kolor turkusowy reprezentuje przeciwciała przeciwcentromerowe (ang. anti-centromere antibodies (ACA)), które reagują z jednym z białek tworzących centromer, tzw. centromerowym białkiem B (CENP-B). Kolor czerwony reprezentuje tubulinę wchodzącą w skład wrzeciona podziałowego, a kolor niebieski reprezentuje barwnik Hoechst służący do wybarwiania DNA.
Znaczenie odkrycia
To odkrycie zmienia istniejący dogmat biologii molekularnej mówiący o tym, że kompleks CDK1-cyklina B1 jest jedynym niezbędnym dla wszystkich etapów mitozy. Uzyskane wyniki sugerują także, że inne, pozornie atypowe CDKs, mogą również odgrywać rolę w regulacji cyklu komórkowego. Badacze wykazali znaczenie kompleksu CDK5-cyklina B1 podczas fizjologicznego podziału komórkowego, jednak ten kompleks może odgrywać jeszcze większą rolę w szybko proliferujących komórkach nowotworowych. CDK5 ulega bowiem nadmiernej ekspresji i aktywacji w szerokim spektrum nowotworów i jest to związane z niekorzystnym rokowaniem. Sugeruje to, że rozwój wielu nowotworów może być zależny od poziomu CDK5. Dlatego, podobnie jak istniejące terapie ukierunkowane na CDKs (inhibitory CDK4/6 stosowane w leczeniu raka piersi), CDK5 może być w przyszłości ważnym celem terapeutycznym w leczeniu raka.
Doktor Bartłomiej Tomasik jest współkoordynatorem zespołu badawczego IDUB zajmującego się biologicznymi i fizycznymi aspektami promieniowania jonizującego oraz ich przełożeniem na praktykę kliniczną. Grupa aktywnie poszukuje partnerów do dalszych działań naukowych. Osoby zainteresowane współpracą mogą uzyskać szczegółowe informacje drogą mailową, kontaktując się z dr. Tomasikiem pod adresem bartlomiej.tomasik@gumed.edu.pl.
grafika: archiwum prywatne