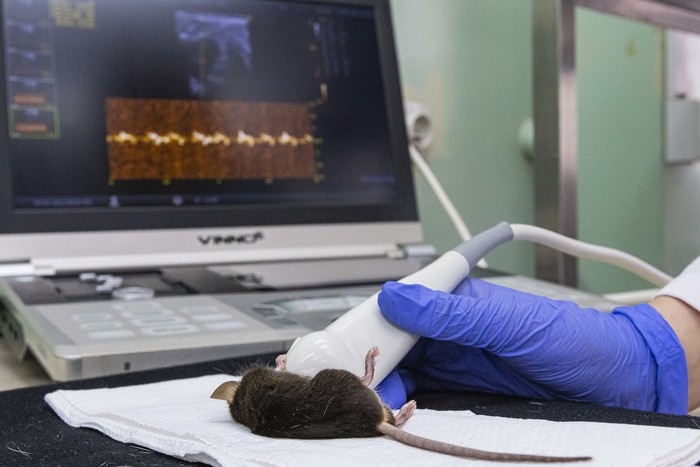
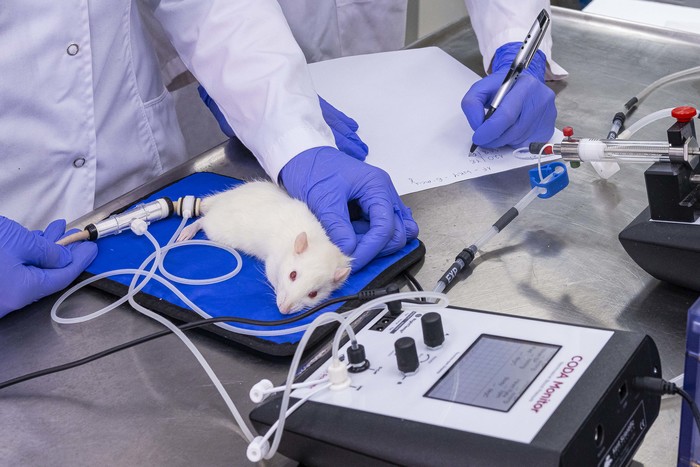
Międzywydziałowe Laboratorium badań in vivo
W ramach programu „Inicjatywa Doskonałości – Uczelnia Badawcza” w Gdańskim Uniwersytecie Medycznym działalność rozpoczyna nowe, międzywydziałowe core facility – Laboratorium badań in vivo.
Jednostka powstała dzięki inicjatywie jednej z koordynatorek zespołu V „In vivo studies on mechanism of disease and therapy” w POB 3 i stanowi efekt współpracy doświadczonych naukowców z:
- Zakładu Anatomii i Neurobiologii,
- Zakładu Chemii Klinicznej,
- Katedry i Zakładu Farmakologii,
- Katedry i Zakładu Biochemii,
- Katedry Biofarmacji i Farmakodynamiki (w tym Zakładu Biofarmacji i Farmakokinetyki, Zakładu Farmakodynamiki).
Nasz potencjał i zakres usług
Z uwagi na interdyscyplinarny charakter jednostki współpraca z Laboratorium Badań in vivo umożliwia zaplanowanie oraz wykonanie specjalistycznych badań in vivo oraz analiz z różnych dziedzin medycyny doświadczalnej podczas jednego projektu badawczego lub badania przedklinicznego.
Jednostka świadczy szeroki zakres usług z obszaru badań in vivo, w tym:
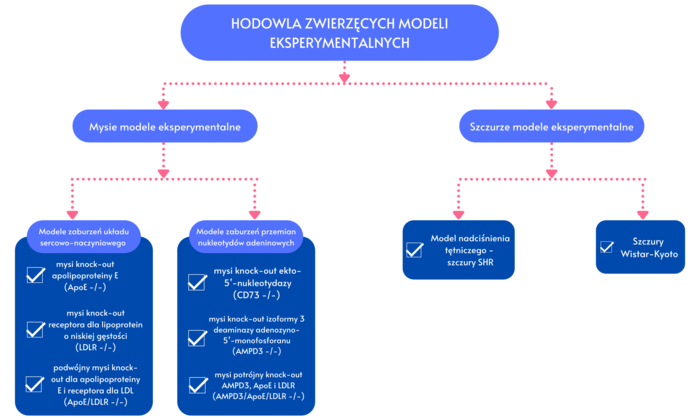
1. Hodowla unikatowych mysich oraz szczurzych modeli eksperymentalnych:
2. Wykonywanie badań eksperymentalnych z zakresu:
- neurobiologii i neuroanatomii doświadczalnej:
- testy behawioralne zwierząt doświadczalnych,
- tworzenie zwierzęcych modeli doświadczalnych udarów mózgowych krwotocznych i niedokrwiennych,
- tworzenie zwierzęcych modeli otyłości/cukrzycy typu 2,
- zastosowanie metody stereologii w badaniach neurologicznych.
- nefrologii doświadczalnej:
- tworzenie zwierzęcych modeli nefrologii doświadczalnej: cukrzycy indukowanej streptazotocyną, hiperangiotensynemii indukowanej dietą o niskiej zawartości jonów sodu, hipercholesterolemii indukowanej dietą o zwiększonej zawartości cholesterolu, model przewlekłego odnerwienia nerek,
- ocena wydalania z moczem elektrolitów, białek i metabolitów z wykorzystaniem klatek metabolicznych,
- dopplerowski pomiar przepływu krwi przez korę i rdzeń nerek,
- ocena filtracji kłębuszkowej w oparciu o klirens radioaktywnej inuliny oraz transdermalny pomiar sygnału fluorescencyjnego z wykorzystanie FITC-sinstryny,
- mikrodializa płynu śródmiąższowego kory nerek,
- miografia tętnic nerkowych,
- pomiar objętości wewnątrz kapilarnej izolowanych kłębuszków nerkowych,
- ocena perystaltyki jelit u szczurów „ex vivo” w różnych sytuacjach klinicznych.
- kardiologii doświadczalnej:
- pomiar parametrów skurczu mięśni gładkich i mięśnia sercowego (mięsień brodawkowaty),
- ocena zmian płucnych naczyniowych i miąższowych w nadciśnieniu płucnym,
- ocena agregacji płytek na materiale ludzkim oraz z modelu cukrzycy u królika spowodowanej streptazotocyną,
- telemetryczny pomiar ciśnienia i częstości pracy serca oraz temperatury wewnętrznej w różnych modelach doświadczalnych jak nadciśnienie płucne, cukrzyca,
- pomiar EKG u zwierząt laboratoryjnych (w warunkach normoksji lub hipoksji),
- pomiar ECHO serca u zwierząt laboratoryjnych,
- pomiar siły mięśniowej zwierząt laboratoryjnych,
- badania funkcji i metabolizmu izolowanych narządów (w układzie perfuzji Langendorffa),
- badanie funkcji i metabolizmu izolowanych mitochondriów,
- badanie preferencji substratowej serca i mięśni szkieletowych zwierzęcych modeli doświadczalnych,
- badania z wykorzystaniem modelu izolowanych przedsionków serca szczura.
- onkologii doświadczalnej:
- chemia indukcyjna (MPA, DMBA) raka piersi u myszy,
- ortotopowy model mysiego raka piersi (wstrzyknięcie komórek raka piersi do poduszki tłuszczowej sutka),
- syngeniczny model mysiego czerniaka (podskórne wstrzyknięcie komórek czerniaka),
- pozyskiwanie pierwotnych kultur komórkowych (mechaniczne/enzymatyczne metody izolacji komórek nowotworowych lub śródbłonka płuc i generowanie pierwotnych kultur komórkowych).
- farmakologii doświadczalnej:
- ocena efektywności środków przeciwbólowych,
- wyznaczanie profili farmakokinetycznych.
3. Wykonywanie ilościowych oznaczeń związków oraz analiz biochemicznych w próbkach biologicznych pochodzenia zwierzęcego:
- analiza składu lipoprotein osocza krwi,
- ocena parametrów biochemicznych osocza i surowicy,
- oznaczenia stężeń związków azotowych (nukleotydy, aminokwasy, metabolity nikotynamidu i ich pochodne).
4. Wsparcie w podstawowych procedurach z zakresu badań in vivo oraz innych metodach badawczych w tym:
- przewlekłe podawanie związków biologicznie czynnych przy użyciu pomp osmotycznych,
- podanie podskórne, dootrzewnowe, dożylne farmaceutyków,
- przyżyciowe pobieranie krwi,
- intubacja i sztuczna wentylacja (kluczowa dla badań metabolizmu),
- nekropsja (eutanazja zwierząt, izolacja narządów i tkanek, analiza stereoskopowa przerzutów),
- przygotowanie tkanek zwierzęcych do badań, histologicznych/immunohistochemicznych oraz analiza preparatów histologicznych i immunohistochemicznych,
- badania izolowanych skrawków tkanek zwierzęcych.
Laboratorium oferuje również pracownikom, doktorantom GUMed oraz jednostkom zewnętrznym możliwość konsultacji w ramach prowadzonych projektów badawczo-rozwojowych oraz przeprowadzanie tematycznych warsztatów praktycznych dla badaczy oraz klinicystów z wykorzystaniem zwierzęcych modeli badawczych (m.in. z dziedziny neurochirurgii czy też mikrochirurgii).
fot. Paweł Sudara/GUMed
Cennik:
Współpraca z laboratorium może mieć charakter usługowy lub niekomercyjny (wspólne projekty naukowo-badawcze, publikacje naukowe).
Pracownie będą wykonywać analizy zgodnie z indywidualnymi zleceniami z dostosowaniem do konkretnych potrzeb kontrahentów. Koszt usługi wyceniany jest indywidualnie.
KONTAKT

dr Marta Tomczyk
kierownik Laboratorium Badań in vivo
Gdański Uniwersytet Medyczny
tel.: 58 349 14 60
marta.tomczyk@gumed.edu.pl