Laboratorium Analityki Toksykologicznej
Katedra i Zakład Toksykologii
Wydział Farmaceutyczny
O NAS
Laboratorium Analityki Toksykologicznej przy Katedrze i Zakładzie Toksykologii Wydziału Farmaceutycznego Gdańskiego Uniwersytetu Medycznego specjalizuje się w zakresie analizy śladowej ksenobiotyków w materiale biologicznym oraz próbkach środowiskowych. Dzięki wieloletniemu doświadczeniu pracownicy jednostki mogą zaoferować wsparcie merytoryczne doktorantom i pracownikom GUMed oraz instytucjom zewnętrznym w ramach prowadzonych badań i projektów.
NASZ POTENCJAŁ
Oferujemy współpracę w zakresie: rozwoju, optymalizacji i walidacji metod analitycznych do jakościowej i ilościowej analizy ksenobiotyków (substancje lecznicze, narkotyki, alkohole, pestycydy) i ich metabolitów w materiale biologicznym (biomonitoring) i próbkach środowiskowych.
Wykorzystywane w laboratorium procedury analityczne podlegają rutynowej kontroli wewnątrz- i zewnątrzlaboratoryjnej (uczestnictwo w programie German External Quality Assessment Scheme (G-EQUAS) oraz projekcie HBM4EU).
- Matryce biologiczne: mocz, krew, płyn pęcherzykowy, włosy, ślina
- Lista analizowanych substancji uwzględnia m.in.:
- isfenol A oraz jego analogi strukturalne, parabeny oraz inne substancje z grupy endocrine disruptors,
- metabolity syntetycznych pyretroidów,
- fipronil
- Wykorzystywane techniki instrumentalne: GC-MS/MS, LC-MS/MS
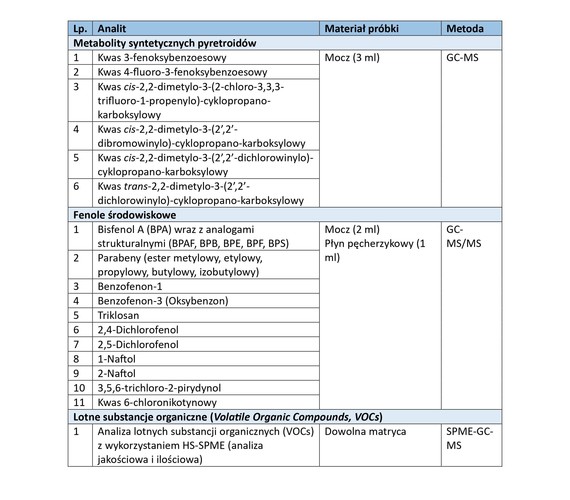
Tabela 1. Wykaz dostępnych metod analitycznych z zakresu monitoringu biologicznego
ZAKRES USŁUG
- optymalizacja i walidacja metod ekstrakcji (m.in. SPE, LLE, head-space)
- optymalizacja warunków rozdzielenia chromatograficznego (GC i LC)
- optymalizacja warunków detekcji MS i MS/MS (GC i LC)
- analiza farmaceutyczna
- analiza wybranych ksenobiotyków i ich metabolitów w próbkach biologicznych
- badanie toksykokinetyki ksenobiotyków
- badanie biotransformacji in chemico z wykorzystaniem celi elektrochemicznej (ROXY EC System, Antec)
- szacowanie wielkości narażenia na podstawie pomiaru stężenia biomarkerów ekspozycji w materiale biologicznym
- kontrola jakości izolatów pęcherzyków zewnątrzkomórkowych z wykorzystaniem elektroforezy kapilarnej. Technika ta może być również wykorzystywana do kontroli jakości produktów farmaceutycznych i biotechnologicznych, w analizie chiralnej i badaniu czystości leków. Dedykowana jest przede wszystkim rozdzielaniu substancji hydrofilowych. System przystosowany jest do implementacji podstawowych technik elektromigracyjnych (CZE, MEKC, ITP, cIEF, CGE).
DOSTĘPNA APARATURA
- Chromatograf gazowy (Varian 3800) sprzężony ze spektrometrem mas typu potrójny kwadrupol (Varian 320ms)

- Chromatograf gazowy (Varian 450) sprzężony ze spektrometrem mas typu kwadrupolowa pułapka jonowa (Varian 220ms)

- Chromatograf gazowy (Scion 436) sprzężony z detektorem płomieniowo-jonizacyjnym (FID) oraz przystawką do analizy fazy nadpowierzchniowej

- Chromatograf gazowy (Bruker 456) sprzężony z detektorem wychwytu elektronów (ECD)

- Chromatograf cieczowy (Varian) sprzężony ze spektrometrem mas typu potrójny kwadrupol (Varian 320ms)

- Chromatografy cieczowe z detektorami: DAD, UV/Vis, fluorescencyjnym, elektrochemicznym
- Elektroforeza kapilarna z detektorem DAD oraz LIF
CENNIK
Koszt usługi wyceniany jest indywidualnie po zapoznaniu się z zapotrzebowaniem zleceniobiorcy.
PUBLIKACJE
Publikacje powstałe w oparciu o wyniki uzyskane w laboratorium:
1. Steć A, Chodkowska M, Kasprzyk-Pochopień J, Mielczarek P, Piekoszewski W, Lewczuk B, Płoska A, Kalinowski L, Wielgomas B, Dziomba S. Isolation of Citrus lemon extracellular vesicles: Development and process control using capillary electrophoresis. Food Chem. 2023 May 12;424:136333. doi: 10.1016/j.foodchem.2023.136333. Epub ahead of print. PMID: 37201469.
2. Klimowska A, Wynendaele E, Wielgomas B. Quantification and stability assessment of urinary phenolic and acidic biomarkers of non-persistent chemicals using the SPE-GC/MS/MS method. Anal Bioanal Chem. 2023 May;415(12):2227-2238. doi: 10.1007/s00216-023-04633-7. Epub 2023 Mar 18. PMID: 36933054; PMCID: PMC10115689.
3. Radwan P, Wielgomas B, Radwan M, Krasiński R, Bujak-Pietrek S, Polańska K, Kilanowicz A, Jurewicz J. Urinary concentration of selected nonpersistent endocrine disrupting chemicals-reproductive outcomes among women from a fertility clinic. Environ Sci Pollut Res Int. 2023 Mar;30(15):45088-45096. doi: 10.1007/s11356-023-25355-4. Epub 2023 Jan 26. PMID: 36701050; PMCID: PMC10076394.
4. Radwan P, Wielgomas B, Radwan M, Krasiński R, Kilanowicz-Sapota A, Banaszczyk R, Jurewicz J. Synthetic Pyrethroids Exposure and Embryological Outcomes: A Cohort Study in Women from Fertility Clinic. Int J Environ Res Public Health. 2022 Apr 22;19(9):5117. doi: 10.3390/ijerph19095117. PMID: 35564520; PMCID: PMC9100335.
5. Rodzaj W, Wileńska M, Klimowska A, Dziewirska E, Jurewicz J, Walczak-Jędrzejowska R, Słowikowska-Hilczer J, Hanke W, Wielgomas B. Concentrations of urinary biomarkers and predictors of exposure to pyrethroid insecticides in young, Polish, urban-dwelling men. Sci Total Environ. 2021 Jun 15;773:145666. doi: 10.1016/j.scitotenv.2021.145666. Epub 2021 Feb 6. PMID: 33596511.
6. Radwan P, Wielgomas B, Radwan M, Krasiński R, Klimowska A, Zajdel R, Kaleta D, Jurewicz J. Triclosan exposure and in vitro fertilization treatment outcomes in women undergoing in vitro fertilization. Environ Sci Pollut Res Int. 2021 Mar;28(10):12993-12999. doi: 10.1007/s11356-020-11287-w. Epub 2020 Oct 23. PMID: 33097990; PMCID: PMC7921062.
7. Klimowska A, Amenda K, Rodzaj W, Wileńska M, Jurewicz J, Wielgomas B. Evaluation of 1-year urinary excretion of eight metabolites of synthetic pyrethroids, chlorpyrifos, and neonicotinoids. Environ Int. 2020 Dec;145:106119. doi: 10.1016/j.envint.2020.106119. Epub 2020 Sep 17. PMID: 32950790.
8. Jurewicz J, Radwan P, Wielgomas B, Radwan M, Karwacka A, Kałużny P, Piskunowicz M, Dziewirska E, Hanke W. Exposure to pyrethroid pesticides and ovarian reserve. Environ Int. 2020 Nov;144:106028. doi: 10.1016/j.envint.2020.106028. Epub 2020 Aug 11. PMID: 32795752.
9. Krenczkowska D, Mojsiewicz-Pieńkowska K, Wielgomas B, Bazar D, Jankowski Z. Ex Vivo Human Skin is not a Barrier for Cyclic Siloxanes (Cyclic Silicones): Evidence of Diffusion, Bioaccumulation, and Risk of Dermal Absorption Using a New Validated GC-FID Procedure. Pharmaceutics. 2020 Jun 24;12(6):586. doi: 10.3390/pharmaceutics12060586. PMID: 32599732; PMCID: PMC7355424.
10. Piotrowska M, Ciura K, Zalewska M, Dawid M, Correia B, Sawicka P, Lewczuk B, Kasprzyk J, Sola L, Piekoszewski W, Wielgomas B, Waleron K, Dziomba S. Capillary zone electrophoresis of bacterial extracellular vesicles: A proof of concept. J Chromatogr A. 2020 Jun 21;1621:461047. doi: 10.1016/j.chroma.2020.461047. Epub 2020 Mar 13. PMID: 32197757.
11. Klimowska A, Wielgomas B. Off-line microextraction by packed sorbent combined with on solid support derivatization and GC-MS: Application for the analysis of five pyrethroid metabolites in urine samples. Talanta. 2018 Jan 1;176:165-171. doi: 10.1016/j.talanta.2017.08.011. Epub 2017 Aug 9. PMID: 28917736.
KONTAKT
dr Michał May
michal.may@gumed.edu.pl
Laboratorium Analityki Toksykologicznej
przy Katedrze i Zakładzie przy Katedrze i Zakładzie Toksykologii
Wydział Farmaceutyczny
Gdański Uniwersytet Medyczny
al. Gen. J. Hallera 107
80-416 Gdańsk
tel. 58 349 16 75
fot. Paweł Sudara/GUMed