Laboratorium Badań nad Hemostazą
Katedra i Zakład Patofizjologii Farmaceutycznej
Wydział Farmaceutyczny
Katedra Biochemii Klinicznej, Zakład Medycyny Molekularnej
Wydział Lekarski
Działalność core facility
Laboratorium powstało we współpracy pracowników Katedry i Zakładu Patofizjologii Farmaceutycznej i Katedry Biochemii Klinicznej. W naszej pracy naukowej zajmujemy się nanomedycyną eksperymentalną, farmakologią płytki krwi, badaniami interakcji płytek krwi z komórkami nowotworowymi i rolą trombocytów w procesie metastazy. Oferujemy możliwość wykonania eksperymentów bądź wsparcia merytorycznego w ramach prowadzonych przez Państwa projektów. W naszej pracy naukowej wykorzystujemy następujące metody: hodowlę komórek eukariotycznych, w tym organoidów; ocenę cytotoksyczności substancji; technikę western blot; reakcję PCR; testy ELISA; cytometrię przepływową, mikroskopię fluorescencyjną, agregometrię świetlną. Posiadamy również doświadczenie w zdobywaniu finansowaniu ze źródeł zewnętrznych.
Współpracujemy z zespołami badawczymi z kraju i z zagranicy:
- University of Saskatchewan College of Medicine, Saskatoon, Canada
- School of Pharmacy and Pharmaceutical Sciences and School of Medicine, Trinity Biomedical Sciences Institute, Trinity College Dublin, Ireland
- Department of Chemistry, University of Ioannina, Greece
- Department of Surgery Surgical Research, Friedrich-Alexander-Universität Erlangen-Nürnberg, Germany
- Pracownia Technologii Organicznych Materiałów Funkcjonalnych, Wydział Chemii, Uniwersytet Warszawski
- Sekcja Mikroskopii Elektronowej, Wydział Biologii, Uniwersytet Gdański
- Katedra Biochemii Molekularnej, Wydział Chemii, Uniwersytet Gdański
- Katedra Technologii Środowiska, Wydział Chemii, Uniwersytet Gdański
- Katedra Chemii Biomedycznej, Wydział Chemii, Uniwersytet Gdański
- Katedra Chemii Nieorganicznej, Wydział Chemii, Uniwersytet Gdański
- Katedra Chemii Organicznej, Wydział Chemii, Politechnika Gdańska
- Katedra i Zakład Farmakologii, Gdański Uniwersytet Medyczny
- Katedra i Zakład Farmacji Stosowanej, Gdański Uniwersytet Medyczny
- Katedra i Zakład Farmakognozji, Gdański Uniwersytet Medyczny
- Katedra i Zakład Mikrobiologii Farmaceutycznej, Gdański Uniwersytet Medyczny
- Katedra i Zakład Chemii Nieorganicznej, Gdański Uniwersytet Medyczny
W laboratorium wykonujemy analizę patomechanizmów na poziomie molekularnym, które stanowią podłoże różnych chorób. Prace nad poznaniem podłoża molekularnego różnych jednostek chorobowych prowadzimy zarówno na poziomie in vitro, ex vivo, jaki i in vivo, dlatego rozwinęliśmy ścisłą współpracę z Kolegami i Koleżankami z różnych Katedr i Klinik naszej Uczelni. W swojej pracy naukowej wykorzystujemy następujące techniki: izolacja różnego rodzaju kwasów nukleinowych z materiału biologicznego; określenie polimorfizmów, mutacji wybranych genów – PCR w czasie rzeczywistym; ocena poziomu ekspresji genów – RT-PCR w czasie rzeczywistym; analiza jakościowa i ilościowa mikroRNA – RT-PCR w czasie rzeczywistym; hodowla komórkowa (linie komórkowe i linie pierwotne); ocena cytotoksyczności wybranych związków: MTT, LDH, AP; ocena ilości białka: ELISA, Western blot, immunofluorescencja; nadekspresja lub wyciszanie ekspresji genów za pomocą shRNA z wykorzystaniem systemu lentiwirusów. W zakresie wyżej wymienionych metod molekularnych oferujemy zarówno wsparcie merytoryczne, jaki i wykonanie eksperymentów.
Dostępne urządzenia i aparatura
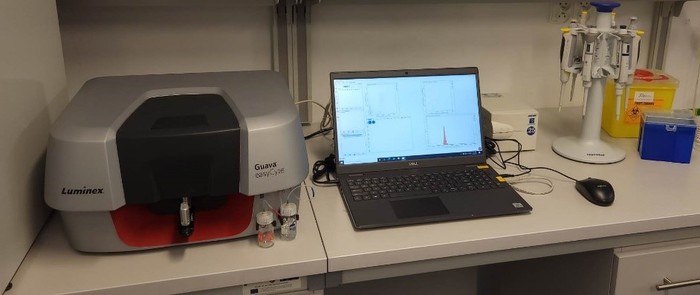
Guava easyCyte 5 Flow Cytometer – kapilarny cytometr przepływowy, który z wykorzystaniem fotopowielaczy (PMT), umożliwia detekcję w 3 kanałach fluorescencji oraz detekcję światła rozproszonego (FSC – przedni detektor światła rozproszonego i SSC – tylny detektor światła rozproszonego) w celu uzyskania informacji odpowiednio o względnej wielkości komórek oraz wielkości i gęstości ziarnistości w cytoplazmie.
- wzbudzanie – laser niebieski: 488 nm (50 mW)
- detekcja zielony 525/30 nm; żółty: 583/26 nm; czerwony: 695/50 nm
- minimalna objętość badanej próby – 150 µl w probówce
- minimalna gęstość komórek do analizy – 10 komórek/µl
- możliwość analizy komórek w zakresie wielkości 0,4-60 µm
- system nie wymaga stosowania płynów osłonowych
- bezpośredni pomiar stężenia komórek w dowolnej objętości próby bez konieczności stosowania dodatkowych odczynników wzorcowych
- oprogramowanie do zarzadzania parametrami pracy urządzenia i analizy uzyskanych danych

Diagnostyczny Fluorescencyjny Mikroskop Odwrócony Serii MW 50 (wersja MW50FL)
- obiektywy:
- klasy plan achromat PH do jasnego pola i kontrastu fazowego 4x, 10x:
- 4X/0.13, WD10.4mm
- 10X/0.25, WD7.3mm
- klasy semi plan apochromat PH ze szkła fluorytowego do jasnego pola i kontrastu fazowego 20X, 40X:
- 20X/0.45, WD5.91mm
- 40X/0.65, WD1.61mm
- klasy semi plan apochromat ze szkła fluorytowego do jasnego pola 4x, 10x, 60x:
- 4X/0.13, WD18.52 mm
- 10X/0.30, WD7.11 mm
- 60X/0.75, WD1.04 mm
- trzymiejscowa wsuwka do kontrastu fazowego i jasnego pola z miejscem na filtry, druga wsuwka
- dwumiejscowa do używania filtrów wraz z kontrastem fazowym, w wyposażeniu filtr zielony i niebieski
- fluorescencja:
- lampa rtęciowa HBO o mocy 100 W
- trzy bloki filtrów z filtrami B, G, UV
- kamera uniwersalna dedykowana do fluorescencji – OPTA-TECH MI5FL o rozdzielczości 5MPix:
- rozmiar piksela: 3,45µm x 3,45µm
- szybkość podglądu na żywo: 35 klatek/s dla rozdzielczości 5MP – maksymalna rozdzielczość zdjęcia: 2448×2048
- migawka „global shutter” – Ekspozycja: od 0.13 ms. – 15s
- klasy plan achromat PH do jasnego pola i kontrastu fazowego 4x, 10x:
Ponadto dysponujemy dwiema w pełni wyposażonymi pracowniami in vitro oraz sprzętem niezbędnym do analizy białek metoda Western blot, wielofunkcyjnym czytnikiem płytek (pomiar fluorescencji, luminescencji i absorbancji), agregometrami świetlnymi, aparaturą potrzebną do przeprowadzenia rekcji PCR oraz spektrofotometrem UV-Vis. Mamy doświadczenie w hodowli pierwotnych oraz komercyjnych linii komórkowych a także organoidów jako model komórkowy 3D. Posiadamy opracowaną metodologię izolacji komórek poszczególnych linii hematopoezy z krwi obwodowej człowieka. W naszym biobanku dysponujemy około 50 różnymi liniami komórkowymi.

System PCR w czasie rzeczywistym LightCycler® 480 Roche
LightCycler® 480 Instrument II to szybki, oparty na 96 dołkowych płytkach cykler ze zintegrowanymi funkcjami wykrywania online w czasie rzeczywistym. Specjalny układ elementów optycznych w aparacie LightCycler® 480 Instrument II zapewnia równomierne zbieranie sygnałów na płytce i sprawia, że analiza jest niezależna od położenia próbki na płytce.
Konfiguracja systemu LightCycler® 480 umożliwia korzystanie ze wszystkich aktualnych formatów sond (np. SYBR Green I, barwnik ResoLight do topienia w wysokiej rozdzielczości, sondy do hydrolizy, sondy HybProbe, sondy SimpleProbe), zapewniając rozwiązanie do szybkiej i precyzyjnej detekcji jakościowej lub ilościowej kwasów nukleinowych, genotypowania i skanowania mutacji. Kanały i filtry można łączyć na różne sposoby, aby zapewnić elastyczność w testach mono-kolorowych i multipleksowych. Wstępnie zainstalowane oprogramowanie LightCycler® 480 zapewnia intuicyjny, łatwy w obsłudze interfejs użytkownika do programowania reakcji PCR w czasie rzeczywistym, przechowywania i analizy danych. Ułatwia wysoce wszechstronną i obszerną analizę danych w celu zbadania ekspresji genów i zmienności genetycznej.
Pracownia mikrobiologiczna BSL-2
Ponadto posiadamy oddzielną pracownię mikrobiologiczną z infrastrukturą również do hodowli komórkowej, gdzie można bezpiecznie pracować z systemami bakteryjnymi czy wirusowymi służącymi do precyzyjnego zwiększania lub wyciszania ekspresji badanych genów.
PUBLIKACJE
Publikacje, które powstały dzięki zastosowaniu opisywanych metod badawczych:
– Inkielewicz-Stepniak I., Tajber L., Behan G., Zhang H., Radomski M.W., Medina C., Santos-Martinez M.J. The Role of Mucin in the Toxicological Impact of Polystyrene Nanoparticles. Materials (Basel). 2018 May 3;11(5):724. doi: 10.3390/ma11050724.
– Medina C., Harmon S., Inkielewicz I., Santos-Martinez M.J., Jones M., Cantwell P., Bazou D., Ledwidge M., Radomski M.W., Gilmer J.F. Differential inhibition of tumour cell-induced platelet aggregation by the nicotinate aspirin prodrug (ST0702) and aspirin. Br J Pharmacol. 2012 Jun;166(3):938-49. doi: 10.1111/j.1476-5381.2011.01794.x.
– Hajtuch J., Santos-Martinez M.J., Wojcik M., Tomczyk E., Jaskiewicz M., Kamysz W., Narajczyk M., Inkielewicz-Stepniak I. Lipoic Acid-Coated Silver Nanoparticles: Biosafety Potential on the Vascular Microenvironment and Antibacterial Properties. Front Pharmacol. 2022 Jan 28;12:733743. doi: 10.3389/fphar.2021.733743.
– Hajtuch J., Iwicka E., Szczoczarz A., Flis D., Megiel E., Cieciórski P., Radomski M.W., Santos-Martinez M.J., Inkielewicz-Stepniak I. The Pharmacological Effects of Silver Nanoparticles Functionalized with Eptifibatide on Platelets and Endothelial Cells. Int J Nanomedicine. 2022 Sep 19;17:4383-4400. doi: 10.2147/IJN.S373691.
– Steckiewicz K.P., Adamska A., Narajczyk M., Megiel E., Inkielewicz-Stepniak I. Fluoride enhances polystyrene nanoparticles cytotoxicity in colonocytes in vitro model. Chem Biol Interact. 2022 Nov 1;367:110169. doi: 10.1016/j.cbi.2022.110169.
– SteckiewicZ K.P., Cieciórski P., Barcińska E., Jaśkiewicz M., Narajczyk M., Bauer M., Kamysz W., Megiel E., Inkielewicz-Stepniak I. Silver Nanoparticles as Chlorhexidine and Metronidazole Drug Delivery Platforms: Their Potential Use in Treating Periodontitis. Int J Nanomedicine. 2022 Feb; 17: 495–517. doi: 10.2147/IJN.S339046.
– Kowalski S., Wyrzykowski D., Hac S., Rychlowski M., Radomski M.W., Inkielewicz-Stepniak I. New Oxidovanadium(IV) Coordination Complex Containing 2-Methylnitrilotriacetate Ligands Induces Cell Cycle Arrest and Autophagy in Human Pancreatic Ductal Adenocarcinoma Cell Lines. Int J Mol Sci. 2019 Jan 10;20(2):261. doi: 10.3390/ijms20020261.
Zakład Medycyny Molekularnej:
– Kowalski R, Pikul P, Lewandowski K, Sakowicz-Burkiewicz M, Pawełczyk T, Zyśk M.: The cAMP Inducers Modify N-Acetylaspartate Metabolism in Wistar Rat Brain (Basel). 2021 Sep 1;10(9):1404. doi: 10.3390/antiox10091404.
– Starzyńska A, Sobocki BK, Sejda A, Sakowicz-Burkiewicz M, Szot O, Jereczek-Fossa BA.: ZNF-281 as the Potential Diagnostic Marker of Oral Squamous Cell Carcinoma. Cancers (Basel). 2021 May 28;13(11):2661. doi: 10.3390/cancers13112661.
– Chyła-Danił G, Sałaga-Zaleska K, Kreft E, Krzesińska A, Herman S, Kuchta A, Sakowicz-Burkiewicz M, Lenartowicz M, Jankowski M.: Suramin Affects the Renal VEGF-A/VEGFR Axis in Short-Term Streptozotocin-Induced Diabetes. Pharmaceuticals (Basel). 2023 Mar 22;16(3):470. doi: 10.3390/ph16030470.
– Zyśk M, Sakowicz-Burkiewicz M, Pikul P, Kowalski R, Michno A, Pawełczyk T.: The Impact of Acetyl-CoA and Aspartate Shortages on the N-Acetylaspartate Level in Different Models of Cholinergic Neurons. Antioxidants (Basel). 2020 Jun 13;9(6):522. doi: 10.3390/antiox9060522.
– Starzyńska A, Adamska P, Sejda A, Sakowicz-Burkiewicz M, Adamski ŁJ, Marvaso G, Wychowański P, Jereczek-Fossa BA.: Any Role of PIK3CA and PTEN Biomarkers in the Prognosis in Oral Squamous Cell Carcinoma? Life (Basel). 2020 Dec 3;10(12):325. doi: 10.3390/life10120325.
– Kreft E, Sałaga-Zaleska K, Sakowicz-Burkiewicz M, Dąbkowski K, Szczepánska-Konkel M, Jankowski M.: Diabetes Affects the A1 Adenosine Receptor-Dependent Action of Diadenosine Tetraphosphate (Ap4A) on Cortical and Medullary Renal Blood Flow. J Vasc Res. 2021;58(1):38-48. doi: 10.1159/000511461.
– Trzeciak M, Olszewska B, Sakowicz-Burkiewicz M, Sokołowska-Wojdyło M, Jankau J, Nowicki RJ, Pawełczyk T.: Expression Profiles of Genes Encoding Cornified Envelope Proteins in Atopic Dermatitis and Cutaneous T-Cell Lymphomas. Nutrients. 2020 Mar 24;12(3):862. doi: 10.3390/nu12030862.
– Starzyńska A, Sobocki BK, Sakowicz-Burkiewicz M, Jereczek-Fossa BA, Alterio D, Szot O, Korwat A, Pęksa R.: VISTA H-Score Is Significantly Associated with a 5-Year DFS Rate in Oral Squamous Cell Carcinoma. J Clin Med. 2023 Feb 17;12(4):1619. doi: 10.3390/jcm12041619.
– Zyśk M, Pikul P, Kowalski R, Lewandowski K, Sakowicz-Burkiewicz M, Pawełczyk T.: Neither Excessive Nitric Oxide Accumulation nor Acute Hyperglycemia Affects the N-Acetylaspartate Network in Wistar Rat Brain Cells. Int J Mol Sci. 2020 Nov 12;21(22):8541. doi: 10.3390/ijms21228541.
– Zyśk M, Gapys B, Ronowska A, Gul-Hinc S, Erlandsson A, Iwanicki A, Sakowicz-Burkiewicz M, Szutowicz A, Bielarczyk H.: Protective effects of voltage-gated calcium channel antagonists against zinc toxicity in SN56 neuroblastoma cholinergic cells. PLoS One. 2018 Dec 20;13(12):e0209363. doi: 10.1371/journal.pone.0209363. eCollection 2018.
– Adamski ŁJ, Starzyńska A, Adamska P, Kunc M, Sakowicz-Burkiewicz M, Marvaso G, Alterio D, Korwat A, Jereczek-Fossa BA, Pęksa R.: High PD-L1 Expression on Tumor Cells Indicates Worse Overall Survival in Advanced Oral Squamous Cell Carcinomas of the Tongue and the Floor of the Mouth but Not in Other Oral Compartments. Biomedicines. 2021 Sep 1;9(9):1132. doi: 10.3390/biomedicines9091132.
– Czaplińska M, Ćwiklińska A, Sakowicz-Burkiewicz M, Wieczorek E, Kuchta A, Kowalski R, Kortas-Stempak B, Dębska-Ślizień A, Jankowski M, Król E.: Apolipoprotein E gene polymorphism and renal function are associated with apolipoprotein E concentration in patients with chronic kidney disease. Lipids Health Dis. 2019 Mar 9;18(1):60. doi: 10.1186/s12944-019-1003-x.
CENNIK
Współpraca z naszą jednostką jest możliwa na zasadach komercyjnych, bądź w ramach współudziału w projektach naukowo-badawczych. Wycena wykonania eksperymentów zostanie przeprowadzona indywidualnie dla każdego projektu.
KONTAKT

prof. Iwona Inkielewicz-Stępniak
Katedra i Zakład Patofizjologii Farmaceutycznej
Wydział Farmaceutyczny
ul. Dębinki 7, budynek 27
80-211 Gdańsk
Numer telefonu 58 349 15 16
Mail iwona.inkielewicz-stepniak@gumed.edu.pl

prof. Monika Sakowicz-Burkiewicz
Zakład Medycyny Molekularnej
Katedra Biochemii Klinicznej
Wydział Lekarski
ul. Dębinki 7, budynek 27
80-211 Gdańsk
Numer telefonu 58 349 27 59
Mail monika.sakowicz-burkiewicz@gumed.edu.pl
fot. Paweł Sudara/GUMed i archiwum prywatne

