Międzykatedralne Laboratorium Analiz Pęcherzyków Zewnątrzkomórkowych
Katedra i Zakład Mikrobiologii Farmaceutycznej
Katedra i Zakład Toksykologii
Wydział Farmaceutyczny
O NAS
Międzykatedralne Laboratorium Analiz Pęcherzyków Zewnątrzkomórkowych powstało w ramach programu „Inicjatywa Doskonałości – Uczelnia Badawcza” prowadzonego przez Gdański Uniwersytet Medyczny po nawiązaniu współpracy pomiędzy Katedrą i Zakładem Mikrobiologii Farmaceutycznej i Katedrą i Zakładem Toksykologii. Prace badawcze zespołu skupiają się wokół szerokiej tematyki pęcherzyków zewnątrzkomórkowych. W ramach prac laboratorium prowadzimy izolację oraz charakterystykę biofizyczną, biochemiczną i molekularną pęcherzyków zewnątrzkomórkowych. Badamy pęcherzyki pochodzenia bakteryjnego, roślinnego oraz organizmów zwierzęcych, w tym pochodzących z hodowli tkankowych.
TEMATYKA BADAŃ
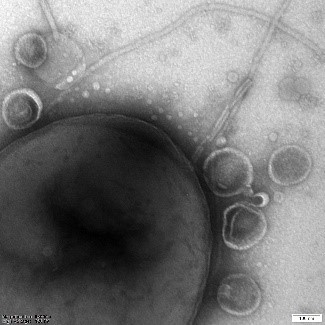
Pęcherzyki zewnątkomórkowe (EVs) to nanostruktury wydzielane przez komórki prokariotyczne i eukariotyczne. Mogą być uwalniane naturalnie (jako produkty uboczne metabolizmu komórkowego związanego z aktywnością ściany komórkowej), ale także jako odpowiedź na stan stresowy. Lipofilowe właściwości błony EVs pozwalają im na łączenie się z błonami komórek docelowych i endocytozę. U ludzi wykryto je w płynach ustrojowych. Oprócz treści jelitowej występują również w osoczu, żółci, ślinie, płynie puchlinowym i płynie z drenażu jamy brzusznej. Są również wydzielane przez komórki nowotworowe. Mogą zawierać różnego rodzaju materiał biologiczny, m.in. białka, kwasy nukleinowe, lipidy czy antybiotyki. Ładunek pęcherzyków zależy od fazy wzrostu komórek rodzicielskich oraz warunków środowiskowych. Określa on ich funkcję. Wiele bakterii chorobotwórczych wykorzystuje EVs do dostarczania toksycznych związków do zainfekowanych komórek. Związki transportowane w EVs mogą również stymulować zmiany w ekspresji genów. EVs biorą udział w wielu procesach biologicznych, takich jak komunikacja między komórkami, modulacja odpowiedzi immunologicznej i poziomy transfer genów.
B – komórka bakteryjna produkująca pęcherzyki zewnątrzkomórkowe
C – roślinne egzosomy i mikropęcherzyki widziane pod mikroskopem krio-elektronowym
NASZ POTENCJAŁ
Katedra i Zakład Mikrobiologii Farmaceutycznej
1. Ultrawirówka stojąca Optima™ XPN 100 Beckman Coulter wraz z rotorami SW 28.1 Ti, SW 70.1 Ti oraz SW 50.1 Ti
2. CFX Connect Real-Time PCR Detection System Bio-Rad
3. Czytnik mikropłytek Infinite M200 Pro Tecan
Katedra i Zakład Toksykologii
1. Aparat do elektroforezy kapilarnej PACE MDQ plus Sciex
Ultrawirówka Optima™ XPN 100 Beckman Coulter z zestawem rotorów SW 28.1 Ti, SW 70.1 Ti oraz SW 50.1 Ti
CFX Connect Real-Time PCR Detection System Bio-RadInfinite M200 Pro Tecan
Aparat do elektroforezy kapilarnej PACE MDQ plus Sciex
Ultrawirówka Optima™ XPN 100 Beckman Coulter pozwala na wirowanie przy prędkościach do 100 000 min⁻¹. Ekran dotykowy pełni zarówno funkcję wyświetlacza informacji, jak i wejścia sterującego dla urządzenia. Komora wirnika wykonana jest z aluminium i pokryta powłoką chemicznie odpornego epoksydu. Ultrawirówka spełnia normy bezpieczeństwa pracy z biologicznym materiałem zakaźnym.
Posiadamy rotory SW 28.1 Ti, SW 70.1 Ti oraz SW 50.1 Ti które umożliwiają ultrawirowanie szerokiego zakresu objętości próbek przy zróżnicowanych prędkościach wirowania.
System do elektroforezy kapilarnej PACE MDQ plus firmy Sciex wyposażony w detektor PDA oraz LIF pozwala na ocenę czystości analizowanych próbek, jak również badanie heterogenności pęcherzyków w izolacie. Umożliwia także oznaczenie zawartości pęcherzyków w próbce na podstawie porównania z pęcherzykami wzorcowymi.
Termocykler CFX Connect Real-Time PCR Detection System Bio-Rad to sześciokanałowy (pięć kolorów i jeden kanał FRET) system do PCR w czasie rzeczywistym. Zapewnia czułą i niezawodną detekcję dla reakcji singlexplex lub multipleks. Wykrywa do pięciu celów przy objętościach próbek 10 µl. Posiada funkcję gradientu termicznego. Oprogramowania CFX Maestro pozwala na analizę danych.
Czytnik Tecan Infinite M200 Pro Tecan to wielofunkcyjny czytnik mikropłytek. Oferuje możliwość wykonania analizy w oparciu o absorbancję i fluorescencję. Detekcja jest oparta na monochromatorach i nie wymaga filtrów, co umożliwia użytkownikom pomiary w zakresie od 230 do 1000 nm dla absorbancji lub od 300 do 600 nm dla fluorescencji w krokach co 1 nm. Urządzenie umożliwia również przeprowadzenie skanowania absorpcji, pobudzenia i emisji. Posiada opcję wstrzykiwacza.
ZAKRES USŁUG
- izolacja pęcherzyków zewnątrzkomórkowych z materiału biologicznego z wykorzystaniem technik ultrawirowania, precypitacji, chromatografii wykluczania oraz ultrafiltracji
- ocena zawartości pęcherzyków zewnątrzkomórkowych w próbce: oznaczanie zawartości białka (test BCA)
- analiza biofizyczna pęcherzyków: analiza czystości izolatów (elektroforeza kapilarna)
- charakterystyka biochemiczna pęcherzyków obejmująca pomiar aktywności enzymatycznej białek wewnątrzpęcherzykowych metodami fluorometrycznymi i kolorymetrycznymi
- charakterystyka molekularna obejmująca immunodetekcję markerów pęcherzyków zewnątrzkomórkowych przy pomocy techniki Western blot
- izolacja mRNA oraz miRNA z pęcherzyków zewnątrzkomórkowych oraz detekcja wybranych biomarkerów za pomocą techniki RT-qPCR
ZESPÓŁ BADAWCY
W skład zespołu badawczego wchodzą specjaliści z wieloletnim doświadczeniem w pracy z pęcherzykami zewnątrzkomórkowymi.
- dr hab. Krzysztof Waleron Prof. uczelni
- dr hab. Szymon Dziomba
- dr Joanna Jońca
- dr Jolanta Ficińska-Mazurczyk
- mgr Aleksandra Steć
AKTUALNA WSPÓŁPRACA
1. Grant OPUS w konsorcjum z MWB UG GUMed finansowany przez Narodowe Centrum Nauki: Ekologiczna biochemia Pectobacterium – badanie interakcji pomiędzy bakteriami a roślinami. 2019/35/B/NZ9/01973
2. Grant PRELUDIUM finansowany przez Narodowe Centrum Nauki: Ocena czystości i identyfikacja pęcherzyków zewnątrzkomórkowych z wykorzystaniem elektroforezy kapilarnej (nr 2022/45/N/NZ7/01417)
WYBRANE PUBLIKACJE
1. Steć A., Heinz A., Dziomba S. Characterization of extracellular vesicles by capillary zone electrophoresis: A novel concept for characterization of a next-generation drug delivery platform. J Pharm Anal. 2024 May 101004. https://doi.org/10.1016/j.jpha.2024.101004
2. Jonca J, Pirhonen M, Waleron MM, Gawor J, Mrozik A, Smoktunowicz M, et al. Comprehensive phenomic and genomic studies of the species, Pectobacterium cacticida and proposal for reclassification as Alcorniella cacticida comb. nov. Front Plant Sci. 2024 Jan 25;15:1323790. https://doi.org/10.3389/FPLS.2024.1323790/BIBTEX
3. Borowska-Beszta M, Smoktunowicz M, Horoszkiewicz D, Jonca J, Waleron MM, Gawor J, et al. Comparative genomics, pangenomics, and phenomic studies of Pectobacterium betavasculorum strains isolated from sugar beet, potato, sunflower, and artichoke: insights into pathogenicity, virulence determinants, and adaptation to the host plant. Front Plant Sci. 2024 Mar 21;15:1352318. https://doi.org/10.3389/FPLS.2024.1352318/BIBTEX
4. Bleibel L, Dziomba S, Waleron KF, Kowalczyk E, Karbownik MS. Deciphering psychobiotics’ mechanism of action: bacterial extracellular vesicles in the spotlight. Front Microbiol. 2023 Jun 15;14:1211447. https://doi.org/10.3389/FMICB.2023.1211447/BIBTEX
5. Steć A, Targońska M, Karkosińska E, Słowik M, Płoska A, Kalinowski L, et al. Protein overproduction alters exosome secretion in Chinese hamster ovary cells. Anal Bioanal Chem. 2023 Jul 1;415(16):3167–76. https://doi.org/10.1007/S00216-023-04725-4/FIGURES/3
6. Steć A, Chodkowska M, Kasprzyk-Pochopień J, Mielczarek P, Piekoszewski W, Lewczuk B, et al. Isolation of Citrus lemon extracellular vesicles: Development and process control using capillary electrophoresis. Food Chem. 2023 Oct 30;424:136333. https://doi.org/10.1016/J.FOODCHEM.2023.136333
7. Steć A, Jońca J, Waleron K, Waleron M, Płoska A, Kalinowski L, et al. Quality Control of Bacterial Extracellular Vesicles with Total Protein Content Assay, Nanoparticles Tracking Analysis, and Capillary Electrophoresis. Int J Mol Sci. 2022 Apr 1;23(8):4347. https://doi.org/10.3390/IJMS23084347/S1
8. Dziomba S, Wysocka M, Jońca J, Sola L, Steć A, Waleron K, et al. Investigation of selected parameters of capillary zone electrophoresis method for analysis of isolates of outer membrane vesicles. Electrophoresis. 2021 Oct 1;42(20):2010–7. https://doi.org/10.1002/ELPS.202000360
9. Jonca J, Waleron M, Czaplewska P, Bogucka A, Steć A, Dziomba S, et al. Membrane vesicles of Pectobacterium as an effective protein secretion system. Int J Mol Sci. 2021 Nov 1;22(22):12574. https://doi.org/10.3390/IJMS222212574/S1
10.Piotrowska M, Ciura K, Zalewska M, Dawid M, Correia B, Sawicka P, et al. Capillary zone electrophoresis of bacterial extracellular vesicles: A proof of concept. J Chromatogr A. 2020 Jun 21;1621:461047. https://doi.org/10.1016/J.CHROMA.2020.461047
KONTAKT
dr hab. Krzysztof Waleron, prof. uczelni
Katedra i Zakład Mikrobiologii Farmaceutycznej
Wydział Farmaceutyczny
Gdański Uniwersytet Medyczny
Al. Gen. J. Hallera 107
80-416 Gdańsk
Numer telefonu 58 349 19 72
www.microbio.gumed.edu.pl
dr hab. Inż. Szymon Dziomba
Katedra i Zakład Toksykologii
Wydział Farmaceutyczny
Gdański Uniwersytet Medyczny
Al. Gen. J. Hallera 107
80-416 Gdańsk
Numer telefonu 58 349 16 73
E-mail: szymon.dziomba@gumed.edu.pl