Pracownia Obrazowania Przyżyciowego Komórek, Tkanek i Organoidów
Katedra i Zakład Histologii
Wydział Lekarski
O NAS
W ramach core facility współpracują dwie pracownie z Katedry Histologii oraz Katedry Biochemii Wydziału Lekarskiego Gdańskiego Uniwersytetu Medycznego. Obie wyposażone są w mikroskopy odwrócone fluorescencyjne z komorami do inkubacji, które umożliwiają prowadzenie długotrwałych obserwacji komórek (hodowli 2D i 3D), sferoidów, eksplantów oraz organoidów. Badania mogą być realizowane zarówno w warunkach tlenowych, jak i w środowisku o ograniczonym dostępie do tlenu.
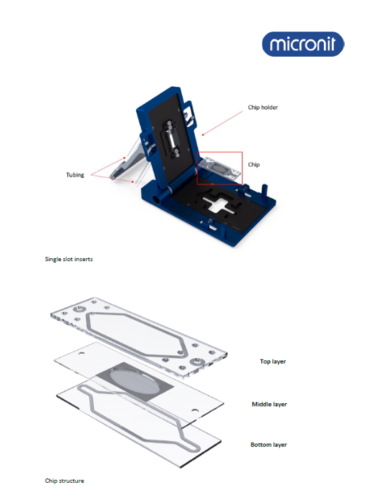
Pracownia dysponuje dwoma unikatowymi systemami hodowli opartymi na technologii mikroprzepływów. Pierwszy z nich, „Organ-on-a-chip” firmy Miconit, umożliwia ciągłą obserwację komórek pod mikroskopem. Drugi system, MIVO (Multi In Vitro Organ System) firmy REACT4LIFE, pozwala na hodowlę większych sferoidów, organoidów oraz eksplantów w warunkach mikroprzepływu. System ten działa w oparciu o inkubator i oferuje możliwość obserwacji mikroskopowej.
Pracownia wyposażona jest w szereg programów do prezentacji oraz modelowania dynamicznego obrazu 2D i 3D, tj.: celSens Dimension Desktop 4.3 z możliwością dekonwolucji 2D, Nearest Neighbor, Wiener, analizy kolokalizacji oraz platformą do analizy z wykorzystaniem uczenia maszynowego TruAI™ Deep-Learning Technology Olympus (Olympus, Japan).
Systemy te umożliwiają między innymi:
- Badanie interakcji między komórkami
- Analizę mobilności komórek, transmigracji przez barierę śródbłonkową, infiltracji do organoidów i tkanek przez inne rodzaje komórek (np. model infiltracji guzów przez komórki limfatyczne/ komórki pochodzące z ognisk wtórnych – przerzutów)
- Ocenę żywotności i ogólnego stanu komórki wspieraną badaniami biochemicznymi
- Ocenę funkcji komórek, np. analiza produkcji tlenku azotu przez śródbłonek naczyniowy, analiza kurczliwości miocytów poprzez ocenę wewnątrzkomórkowego poziomu wapnia
- Śledzenie przemieszczających się białek wewnątrzkomórkowych i zewnątrzkomórkowych, analiza ich eksternalizacji na powierzchnię błony komórkowej
- Tworzenie modeli 3D in vitro i obserwacji przyżyciowej (np. sieci mitochondrialnych, pęcherzyków wewnątrzkomórkowych)
- Badania cytotoksyczności i metabolizmu leków
- Badania naprężenia ścinającego (shear stress) śródbłonka
- Hodowlę, obserwację, stymulację skrawków organotypowych:
a) ludzkich pozyskiwanych w trakcie zabiegów chirurgicznych np. z niewydolnego mięśnia sercowego lub guzów nowotworowych
b) ze zwierzęcych modeli eksperymentalnych (m.in. z mózgu, serca, płuc, nerek) - Analizę ultrastruktury tkanek i organoidów, np. wizualizację mieszków włosowych czy naczyń krwionośnych
NASZ POTENCJAŁ
Pracownia badań przyżyciowych organoidów
Mikroskop odwrócony fluorescencyjny Olympus IX83
Mikroskop wyposażony jest w:
- Komorę inkubacyjną z dwukanałowym mikserem gazów (możliwość regulacji poziomu tlenu w komorze) i regulacją temperatury
- Kolorową kamerę cyfrową CMOS
- Ultraszybką kamerę monochromatyczną (100 fps przy pełnej rozdzielczości)
- Pełną automatyzację w płaszczyznach x/y/z
- Funkcję Autofocus
- Zestaw obiektywów kontrastowo-fazowych oraz obiektywy plan-apochromatyczne 1,25x, 10x, 20x, imersyjny 60x
- Źródło światła do obserwacji w technice fluorescencji: Zestaw szesnastu elementów LED ·
- Ośmiopozycyjną zautomatyzowaną karuzelę na filtry fluorescencyjne w postaci kasety, w łatwy sposób wysuwanej z mikroskopu. Zamontowane filtry: DAPI, FITC, TRITC, Cy5.
- Polaryzator
- Pakiet oprogramowania posiadający pełną kontrolę funkcji mikroskopu i analizy obrazu, wraz z modułem nawigatora płytek wielodołkowych, analizy danych i dekonwolucji
- Stację roboczą do analizy obrazu
Pracownia hodowli komórkowych i tkankowych
Mikroskop odwrócony fluorescencyjny Zeiss Axio Observer 7
Mikroskop wyposażony jest w:
- Komorę inkubacyjną z dwukanałowym mikserem gazów (możliwość regulacji poziomu tlenu w komorze) i regulacją temperatury
- Wkładkę grzewczą M12 S1 (D) na płytki 6-, 12-, 24-, 48- i 96-dołkowe
- Adaptery do stolika na szkiełka mikroskopowe i naczynia hodowlane
- Kamerę kolorową Axiocam 105 color, USB 3.0 PCIe x1 interface, 1 CMOS, 2560 (H) x 1920 (V) = 5.0 Megapixel
- Cyfrową kamerę monochromatyczną Axiocam 305 mono (D) USB 1 3.0 PCIe x1 interface, USB 3.0 cable 3 m, 5.07 Mega pixel
- Adapter video 60N-C 2/3’’ 0.63x
- Pełną automatyzację w płaszczyznach x/y/z
- Funkcję Autofocus
- System fluorescencyjnego oświetlenia strukturalnego ApoTome.2
- Zestaw obiektywów o zwiększonym kontraście EC Plan-Neofluar do fluorescencji, dostosowanych do obserwacji z ApoTome.2 (10x, 20x, 40x, 62x)
- Źródło światła do obserwacji w technice fluorescencji: Zestaw oświetlacza (D) HXP 120
- Sześciopozycyjną zautomatyzowaną karuzelę na filtry fluorescencyjne.
Zamontowane 2 zestawy filtrów:
1. DAPI, FITC, TRITC, Cy5
2. CFP, YFP, Hc Red
- Kontrast Nomarskiego DIC
- Pakiet oprogramowania Zeiss ZEN 2.6 pro Hardware posiadający pełną kontrolę funkcji mikroskopu i analizy obrazu, wraz z modułem nawigatora płytek wielodołkowych, analizy danych i dekonwolucji
- Stację roboczą do analizy obrazu
System do pozyskiwania skrawków organotypowych i ich hodowli w warunkach długotrwałej inkubacji
System wyposażony jest w:
- Mikrotom oscylacyjny z chłodzeniem, umożliwiający krojenie tkanek w warunkach natlenianianego buforu do izolacji
- Inkubator do hodowli skrawków organotypowych (grubości 100 – 300 mm) z kontrolowaną atmosferą dwutlenku węgla oraz stężeniem tlenu
- System izolacji i hodowli, kompatybilny z obrazowaniem i analizami metabolicznymi wykonywanymi w Laboratorium Analiz Biochemicznych i Obrazowania
- System MEA (Multielectrode Array) rejestrujący potencjały czynnościowe w skrawkach serca (dostępny wkrótce)
- System do stymulacji skrawków serca w polu elektrycznym (dostępny wkrótce)
System MIVO (Multi In Vitro Organ System)
Zestaw „organ o chip” firmy Micornit
System ten umożliwia bezpośrednią i ciągłą obserwację komórek lub organoidów w warunkach mikroprzepływu, ponieważ jest montowany na stoliku mikroskopu. Dzięki temu można badać nie tylko tworzenie organoidów, ale też bezpośredni efekt działania substancji czy terapeutyków, podawanych przy wykorzystaniu sytemu mikroprzepływów.
Ponadto, pracownia wyposażona jest w:
- Komory z laminarnym przepływem powietrza
- Pojemniki do przechowywania preparatów w atmosferze ciekłego azotu
- Łaźnie wodne
- Wirówki preparatywne, mini wirówki i wirówki stołowe
KONTAKT
Katedra i Zakład Histologii
prof. dr hab. Michał Żmijewski
e-mail: mzmijewski@gumed.edu.pl
Katedra i Zakład Biochemii
dr hab. Barbara Kutryb-Zając