Centrum Kardioonkologii Doświadczalnej
Centrum Kardioonkologii Doświadczalnej (CKOD) to ogólnouczelniana jednostka na mapie inicjatyw wspieranych w ramach programu Inicjatywa Doskonałości – Uczelnia Badawcza. Zostało utworzone w 2025 r. celem optymalizacji wykorzystania potencjału naukowo-badawczego GUMed w tematyce kardiologii, onkologii i na pograniczu tych dziedzin. Powstanie CKOD jest bezpośrednim efektem współpracy badaczy z nauk doświadczalnych i klinicznych, wpisującej się we wszystkie Priorytetowe Obszary Badawcze GUMed, tj.: Onkologię, Kardiologię i medycynę sercowo-naczyniową oraz Biochemię, Genetykę i biologię molekularną. Jednostka realizuje projekty translacyjne (ang. from bench to bedside and back again), które dają realną perspektywę wdrożenia rozwiązań diagnostycznych i terapeutycznych opracowywanych z wykorzystaniem unikatowych modeli eksperymentalnych oraz zaawansowanych technik badawczych w standardowej praktyce klinicznej.
Istotnym elementem obecnej pracy jednostki jest integracja interdyscyplinarnego środowiska badaczy z Gdańskiego Uniwersytetu Medycznego i Uniwersyteckiego Centrum Klinicznego w Gdańsku z naukowcami m.in. z Uniwersytetu Jagiellońskiego, Instytutu Immunologii i Terapii Doświadczalnej im. Ludwika Hirszfelda PAN, Instytutu Rozrodu Zwierząt i Badań Żywności Polskiej Akademii Nauk w Olsztynie, Narodowego Instytutu Onkologii im. Marii Skłodowskiej-Curie – Państwowego Instytutu Badawczego, Politechniki Warszawskiej, Centrum Kształcenia Podyplomowego w Warszawie i Narodowego Instytutu Kardiologii – Państwowego Instytutu Badawczego. Celem tej szerokiej współpracy jest opracowanie nowoczesnej diagnostyki i terapii chorób serca oraz naczyń ze szczególnym uwzględnieniem schorzeń przebiegających z dysfunkcją śródbłonka, które mogą być wywołane przez choroby nowotworowe, terapie onkologiczne oraz współwystępujące ryzyko sercowo-naczyniowe. Ponadto, w CKOD prowadzone są badania nad molekularnymi oraz komórkowymi mechanizmami reprogramowania przewodzenia w sercu indukowanego przez radioterapię.
NASZ POTENCJAŁ I ZAKRES USŁUG
Nadrzędnym celem działalności CKOD jest wypracowanie innowacyjnych rozwiązań diagnostycznych i terapeutycznych odpowiadających na obecne wyzwania kliniczne w kardiologii, onkologii i na styku tych dziedzin. Prowadzimy badania o charakterze translacyjnym z zastosowaniem unikatowych modeli eksperymentalnych oraz zaawansowanych technik badawczych.
Główne obszary działalności CKOD obejmują:
- Zastosowanie w badaniach eksperymentalnych modeli komórkowych i zwierzęcych oraz żywych skrawków organotypowych ludzkiego serca oraz naczyń krwionośnych ex vivo;
- Rozwój nowych strategii diagnostycznych poprzez poszukiwanie biomarkerów wczesnego uszkodzenia serca i naczyń w przebiegu chorób nowotworowych oraz w trakcie terapii onkologicznej;
- Poszukiwanie nowych celów terapeutycznych w patologiach układu sercowo-naczyniowego u pacjentów onkologicznych
- Interdyscyplinarne projekty badawcze bazujące na współpracy z ekspertami w ramach Priorytetowych Obszarów Badawczych IDUB oraz uczelni zrzeszonych w ramach Związku Uczelni Fahrenheita
Zaplecze badawcze i dostępna aparatura:
W ramach działalności CKOD badania prowadzone są w 6 pracowniach:
1. Pracownia przyżyciowych skrawków organotypowych serca oraz naczyń
2. Pracownia izolacji i hodowli komórek pierwotnych oraz linii komórkowych
3. Pracownia obrazowania tkanek, skrawków organotypowych, organoidów i hodowli komórkowych
4. Pracownia metabolizmu komórek i tkanek
5. Pracownia napromieniania materiałów, komórek i tkanek
6. Pracownia badań in vivo
1. Pracownia przyżyciowych skrawków organotypowych
- Mikrotom oscylacyjny z chłodzeniem umożliwiający krojenie żywych tkanek w warunkach natlenianianego buforu do izolacji
- Inkubator do hodowli skrawków organotypowych (grubości 100 – 300 μm) z kontrolowaną atmosferą dwutlenku węgla
- System do izolacji i hodowli kompatybilny z obrazowaniem i analizami metabolicznymi
- System rejestrujący potencjały czynnościowe w skrawkach serca ang. Multielectrode Array – MEA
- System do hodowli skrawków serca w warunkach stymulacji w polu elektrycznym (MyoDish In Vitro System)
- System do izolacji naczyń ex vivo
- Ośmiokanałowy zestaw kąpieli krążków naczyniowych (Danish Myo Technology – DMT) z zaawansowanym półautomatycznym systemem płukania przeznaczony do badań odpowiedzi zależnej i niezależnej od śródbłonka izolowanych krążków naczyń krwionośnych usuwanych podczas rutynowych zabiegów inwazyjnych.
2. Pracownia izolacji i hodowli komórek pierwotnych oraz linii komórkowych
- Inkubator do hodowli kultur komórkowych z kontrolowaną atmosferą dwutlenku węgla oraz tlenu
- Komory laminarne z pionowym i poziomym przepływem powietrza
- Odwrócony mikroskop świetlny
- Szybkoobrotowe wirówki laboratoryjne z chłodzeniem
- Wirówka mikrohematokrytowa
- Mikrowirówka
3. Pracownia obrazowania tkanek, skrawków organotypowych, organoidów i hodowli komórkowych
- Odwrócony mikroskop fluorescencyjny Zeiss Axio Observer 7, wyposażony w komorę inkubacyjną z dwukanałowym mikserem gazów (możliwość regulacji poziomu tlenu w komorze) i regulacją temperatury, kamerę kolorową Axiocam 105, cyfrową kamerę monochromatyczną Axiocam 305, pełną automatyzację x/y/z, autofokus, system fluorescencyjnego oświetlenia strukturalnego ApoTome.2, zestaw obiektywów EC Plan-Neofluar (10x, 20x, 40x, 62x), źródło światła HXP 120, 2 zestawy filtrów: 1. DAPI, FITC, TRITC, Cy5 i 2. CFP, YFP, Hc Red, kontrast Nomarskiego DIC i pakiet oprogramowania Zeiss ZEN 2.6 pro Hardware
- Spektrometr mas Orbitrap Exploris 480 współpracujący z źródłem obrazowania masowego AP-MALDI UHR (MassTech)
4. Pracownia metabolizmu komórek i tkanek
- Chromatografy cieczowe Nexera LC 2040 (Shimadzu) i Nexera LC40 (Shimadzu)
- Spektrometr mas Orbitrap Exploris 480 współpracujący z chromatografem cieczowym Vanquish lub nanochromatografem Ultimate 3000 (ThermoFisher)
- Spektrometr Mas MicroTOF-Q2 (Bruker) współpracujący z chromatografem Ultimate 3000 (ThermoFisher) lub nanochromatografem Ultimate 3000
- Spektrometr Mas Quantum TSQ Vantage EMR współpracujący z chromatografem Surveyor lub nanochromatografem Ultimate 3000 (ThermoFisher).
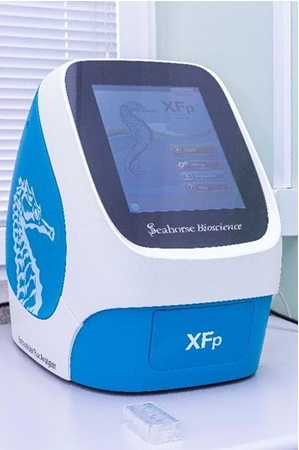
- Analizator metaboliczny Seahorse XFp (Seahorse BioScience), umożliwiający pomiary szybkości konsumpcji tlenu odzwierciedlającej oddychanie mitochondrialne oraz szybkości zewnątrzkomórkowego zakwaszenia odzwierciedlającą glikolizę w żywych komórkach, modelach komórkowych 3D oraz skrawkach tkanek. Szybkość konsumpcji tlenu może być mierzona także w izolowanych mitochondriach lub permeabilizowanych komórkach.
- Automatyczny analizator biochemiczny XL-180 (Erba, Meinheim) z systemem otwartym, przeznaczony jest do pomiarów spektrofotometrycznych i immunoturbidymetrycznych (w zakresie długości fali od 340-700 nm). Analizator posiada szerokie menu testowe, umożliwiające przeprowadzanie oznaczeń biochemicznych w surowicy krwi, osoczu i moczu. Urządzenie posiada obszerny program kontroli jakości, a ponadto pozwala na przeprowadzenie do 180 badań w ciągu godziny. Mała objętość mieszaniny reakcyjnej (180ul) dozowanej przy pomocy precyzyjnej strzykawki szafirowej pozwala na wykorzystanie niewielkiej ilości materiału biologicznego.
5. Pracownia napromieniania materiałów, komórek i tkanek
- Akcelerator Varian Truebeam typu HD, wykorzystujący napięcie przyspieszające 6MV
- Fantomy z plexi wraz z zestawem komór typu Farmer do precyzyjnych pomiarów dawek tygodniowych.
- Urządzenie Quickcheck, wykorzystywane do codziennego monitorowania stabilności akceleratora.
- Fantom MPC, umożliwiający codzienną kontrolę pełnej geometrii aparatu.
- Komory typu Semiflex 3D, przeznaczone do pomiarów w fantomie wodnym oraz komorę Diamond, idealną do pomiarów małych pól w warunkach fantomowych.
- Fantom Octavius 4D PTW oraz matrycę półprzewodnikową dające możliwość weryfikacji planów napromieniania zarówno dla radioterapii frakcjonowanej konwencjonalnie jak i technik stereotaktycznych.
- System weryfikacji planów z użyciem elektronicznego detektora obrazowego (EPID) oraz filmów Gafchromic™, wspomagany przez dedykowany skaner i oprogramowanie do analizy filmów.
- Niezależny system obliczeń dawek Mobius, umożliwiający niezależną weryfikację rozkładu dawki, niezależnie od systemu planowania radioterapii.
- Algorytmy Acuros i AAA, pozwalające na bardziej precyzyjne obliczenia dawki, szczególnie w obecności materiałów o wysokiej gęstości, takich jak implanty tytanowe.
- System obrazowania iMAR na TK, wspierający precyzyjną lokalizację struktur serca z uwzględnieniem materiałów o różnej gęstości.
6. Pracownia badań in vivo
- Szczurze i mysie modele patologii sercowo-naczyniowych w tym nadciśnienia, dyslipidemii, miażdżycy, niewydolności serca i arytmii
- Mysie modele chorób nowotworowych, w tym raka piersi, raka płuc, międzybłoniaka opłucnej i czerniaka.
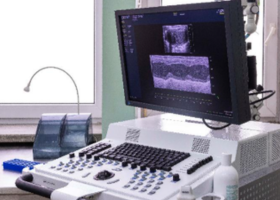
- Aparat do USG i ECHO-Vero 1100 Imaging System
- Aparat do EKG
- System do anestezji wziewnej
- System perfuzji Langerdorfa
- Respirator dla zwierząt laboratoryjnych
Działalność CKOD ma na celu:
- Zacieśnienie współpracy pomiędzy badaczami z nauk eksperymentalnych i klinicznych
- Zwiększenie potencjału do realizacji projektów translacyjnych, uwzględniających badania przedkliniczne w kardiologii, onkologii i na pograniczu tych dziedzin
- Zmniejszenie częstości powikłań sercowo-naczyniowych u pacjentów leczonych onkologicznie, co bezpośrednio przekłada się na lepszą jakość i długość życia.
- Wczesną diagnostykę i precyzyjne monitorowanie stanu układu krążenia w trakcie oraz po zakończeniu terapii przeciwnowotworowej, dzięki wdrażaniu nowoczesnych narzędzi diagnostycznych.
- Personalizację leczenia – lepsze dopasowanie intensywności i rodzaju terapii do indywidualnego profilu pacjenta, z uwzględnieniem ryzyka kardio- i waskulotoksyczności.
- Repozycjonowanie leków – tzw. drug repurposing czyli wykazanie korzystnego działania znanych cząsteczek w obliczu prewencji i terapii schorzeń sercowo-naczyniowych u chorych onkologicznych.
- Poprawę skuteczności radioterapii i chemioterapii poprzez optymalizację dawek oraz schematów leczenia, które minimalizują uszkodzenia mięśnia sercowego i naczyń.
OFERTA
Centrum świadczy usługi dla podmiotów zewnętrznych. Jednostka będzie wykonywać analizy zgodnie z indywidualnymi zleceniami z dostosowaniem do konkretnych potrzeb kontrahentów. Koszt usługi wyceniany jest indywidualnie.
W skład zespołu badawczego wchodzą
Kierownicy merytoryczni i liderzy projektów:
- dr hab. Barbara Kutryb-Zając, prof. uczelni – nadzór nad pracowniami laboratoryjnymi i modelami eksperymentalnymi
- dr Bartłomiej Tomasik – nadzór nad pracownią napromieniania oraz eksperymentami elektrofizjologicznymi z wykorzystaniem macierzy wieloelektrodowych (MEA – multi-electrode array)
Opiekunowie pracowni:
- dr Alicja Braczko, Pracownia Metabolizmu Komórek i Tkanek
- dr Paulina Mierzejewska, Pracownia badań in vivo
- dr inż. Joanna Kamińska, Pracownia Napromieniania Materiałów, Komórek i Tkanek
- dr Marika Frańczak, Pracownia Izolacji i Hodowli Komórek Pierwotnych oraz Linii Komórkowych
- mgr Ada Kawecka, Pracownia Przyżyciowych Skrawków Organotypowych oraz Pracownia Obrazowania
- mgr Klaudia Stawarska, Pracownia Przyżyciowych Skrawków Organotypowych oraz Pracownia Obrazowania
- mgr Iga Walczak, Pracowni Izolacji i Hodowli Komórek Pierwotnych oraz Linii Komórkowych
- mgr inż. Krzysztof Urbanowicz, Pracownia Metabolizmu Komórek i Tkanek oraz Pracownia Obrazowania
DOROBEK NAUKOWY ZESPOŁU
van der Pol LHG, Blanck O, Grehn M, Blazek T, Knybel L, Balgobind BV, Verhoeff JJC, Miszczyk M, Blamek S, Reichl S, Andratschke N, Mehrhof F, Boda-Heggemann J, Tomasik B, Mandija S, Fast MF. Auto-contouring of cardiac substructures for Stereotactic arrhythmia radioablation (STAR): A STOPSTORM.eu consortium study. Radiother Oncol. 2024 Nov 1;202:110610.
Zheng XF, Sarkar A, Lotana H, Syed A, Nguyen H, Ivey RG, Kennedy JJ, Whiteaker JR, Tomasik B, Huang K, Li F, D’Andrea AD, Paulovich AG, Shah K, Spektor A, Chowdhury D. CDK5-cyclin B1 regulates mitotic fidelity. Nature. 2024 Sep;633(8031):932-940.
Zabielska-Kaczorowska M.A.,Stawarska K.,Kawecka A., Urbanowicz K., Smolenski R.T., Kutryb-Zajac B. Nucleotide depletion in hypoxia experimental models of mouse myocardial slices. Nucleosides, Nucleotides & Nucleic Acids, 2024, 43(8), 770–782.
Swift ML, Zhou R, Syed A, Moreau LA, Tomasik B, Tainer JA, Konstantinopoulos PA, D’Andrea AD, He YJ, Chowdhury D. Dynamics of the DYNLL1-MRE11 complex regulate DNA end resection and recruitment of Shieldin to DSBs. Nat Struct Mol Biol. 2023 Oct;30(10):1456-1467. doi: 10.1038/s41594-023-01074-9.
Miszczyk M, Sajdok M, Bednarek J, Latusek T, Wojakowski W, Tomasik B, Wita K, Jadczyk T, Kurzelowski R, Drzewiecka A, Cybulska M, Gardas R, Jarosiński G, Dolla Ł, Grządziel A, Zub K, Bekman A, Kaminiów K, Kozub A, Gołba KS, Blamek S. Stereotactic management of arrhythmia – radiosurgery in treatment of ventricular tachycardia (SMART-VT). Results of a prospective safety trial. Radiother Oncol. 2023 Nov;188:109857.
Chałubińska-Fendler J, Nowicka Z, Dróżdż I, Graczyk Ł, Piotrowski G, Tomasik B, Spych M, Fijuth J, Papis-Ubych A, Kędzierawski P, Kozono D, Fendler W. Radiation-induced circulating microRNAs linked to echocardiography parameters after radiotherapy. Front Oncol. 2023 May 18;13:1150979. doi: 10.3389/fonc.2023.1150979.
Hawryszko M, Sławiński G, Tomasik B, Lewicka E. Cardiac Arrhythmias in Patients Treated for Lung Cancer: A Review. Cancers (Basel). 2023 Dec 6;15(24):5723.
Grehn M, Mandija S, Miszczyk M, Krug D, Tomasik B, Stickney KE, Alcantara P, Alongi F, Anselmino M, Aranda RS, Balgobind BV, Boda-Heggemann J, Boldt LH, Bottoni N, Cvek J, Elicin O, De Ferrari GM, Hassink RJ, Hazelaar C, Hindricks G, Hurkmans C, Iotti C, Jadczyk T, Jiravsky O, Jumeau R, Kristiansen SB, Levis M, López MA, Martí-Almor J, Mehrhof F, Møller DS, Molon G, Ouss A, Peichl P, Plasek J, Postema PG, Quesada A, Reichlin T, Rordorf R, Rudic B, Saguner AM, Ter Bekke RMA, Torrecilla JL, Troost EGC, Vitolo V, Andratschke N, Zeppenfeld K, Blamek S, Fast M, de Panfilis L, Blanck O, Pruvot E, Verhoeff JJC. STereotactic Arrhythmia Radioablation (STAR): the Standardized Treatment and Outcome Platform for Stereotactic Therapy Of Re-entrant tachycardia by a Multidisciplinary consortium (STOPSTORM.eu) and review of current patterns of STAR practice in Europe. Europace. 2023 Apr 15;25(4):1284-1295.
Kutryb-Zajac B., Kawecka A., Nasadiuk K., Braczko A., Stawarska K., Caiazzo E., Koszalka P., Cicala C. Drugs targeting adenosine signaling pathways: a current view. Biomedicine & Pharmacotherapy, 2023, 165, 115184
Fendler W, Tomasik B, Atkins K, Stawiski K, Chałubińska-Fendler J, Kozono D. The clinician’s guide to radiotherapy complications. Pol Arch Intern Med. 2022
Kutryb-Zajac B., Kawecka A., Braczko A., Franczak M., Slominska EM., Giovannoni R., Smolenski RT. CoCl2-mimicked endothelial cell hypoxia induces nucleotide depletion and functional impairment that is reversed by nucleotide precursors. Biomedicines, 2022, 10(7), 1540
Koszalka P., Kutryb-Zajac B., Mierzejewska P., Tomczyk M., Wietrzyk., Serafin P., Smolenski RT., Slominska EM. 4-Pyridone-3-carboxamide-1-β-D-ribonucleoside (4PYR) — A Novel Oncometabolite Modulating Cancer-Endothelial Interactions in Breast Cancer Metastasis. International Journal of Molecular Sciences, 2022, 23(19), 5774
Jedrzejewska A., Kutryb-Zajac B., Krol O., Harasim G., Franczak M., Jablonska P., Slominska EM., Smolenski RT. The decreased serum activity of cytosolic 5’-nucleotidase IA as a potential marker of breast cancer-associated muscle inflammation. Nucleosides Nucleotides Nucleic Acids, 2022, 41(3), 273-284.
Mierzejewska P., Kunc M., Zabielska-Kaczorowska M., Kutryb-Zajac B., Pelikant-Malecka I., Braczko A., Jablonska P., Romaszko P., Koszalka P., Szade J., Smolenski RT, Slominska EM. An unusual nicotinamide derivative, 4-pyridone-3-carboxamide ribonucleoside (4PYR), is a novel endothelial toxin and oncometabolite. Experimental and Molecular Medicine, 2021, 53, 9, 1402-1412
Kutryb-Zajac B., Harasim G., Jedrzejewska A., Krol O., Braczko A., Jablonska P., Mierzejewska P., Zielinski J., Slominska EM. Smolenski RT. Macrophage-Derived Adenosine Deaminase 2 Correlates with M2 Macrophage Phenotype in Triple Negative Breast Cancer. Int. J. Mol. Sci. 2021, 22(7), 3764;
Mateuszuk Ł., Campagna R., Kutryb-Zając B., Kuś K.l, Słomińska EM., Smoleński RT, Chlopicki S. Reversal of endothelial dysfunction by nicotinamide mononucleotide via extracellular conversion to nicotinamide riboside. Biochem. Pharmacol. 2020 : vol. 178, art. ID 114019, s. 1-11.
Chalubinska-Fendler J, Graczyk L, Piotrowski G, Wyka K, Nowicka Z, Tomasik B, Fijuth J, Kozono D, Fendler W. Lipopolysaccharide-Binding Protein Is an Early Biomarker of Cardiac Function After Radiation Therapy for Breast Cancer. Int J Radiat Oncol Biol Phys. 2019 Aug 1;104(5):1074-1083. doi: 10.1016/j.ijrobp.2019.04.002.
KONTAKT

dr hab. Barbara Kutryb-Zając, prof. uczelni
Katedra i Zakład Biochemii
Gdański Uniwersytet Medyczny
Numer telefonu 58 349 14 60
Mail barbara.kutryb-zajac@gumed.edu.pl

dr Bartłomiej Tomasik
Katedra i Klinika Onkologii i Radioterapii GUMed
Gdański Uniwersytet Medyczny
Numer telefonu 58 584 45 60
Mail bartlomiej.tomasik@gumed.edu.pl
fot. Paweł Sudara/GUMed i archiwum prywatne